https://www.youtube.com/watch?v=_2FZ3zbmsyg
5. Vand

Vand skaber liv, vand er en menneskeret
Vand er forudsætning for liv. Det første liv opstod i havet for næsten 3,8 milliarder siden og vand blev dannet på vores planet 100 millioner år tidligere formentlig under et bombardement af is-meteoritter. I dag er 2/3 af jordens overflade dækket af vand, 60% af menneskets krop består af vand. Og når vi snakker om alkoholiske drikke, så består vin, mjød samt øl af 80% til 95% vand (www.frida.fooddata.dk). Vand er en vigtig ressource for al liv.
Adgang til vand er en menneskeret, har FN flere gange pointeret. Det er civilbefolkningens ret at have adgang til rent drikkevand. Og det er myndighedernes pligt at sikre, at der er lige adgang til rent drikkevand. I Danmark scorer vandforsyningen topkarakterer på de fleste parametre, hvilket i høj grad skyldes at vandforsyningen er demokratisk reguleret af vandforbrugere og stat. Det sikrer stabil vandforsyning, høj vandkvalitet og til en pris som de fleste kan betale.
I store dele af verden ejes vandforsyningen af private, for hvem vandet er en ressource, der skal tjenes penge på. Resultatet er korruption, forureningsskandaler og ustabil vandforsyning. Vandressourcen er en betingelse for liv her på jorden, det er en alt for kostbar ressource at overlade til private interessenter.
Vand udgør typisk mere end 90% af en øl og er dermed en overordentlig vigtig ingrediens i ølbrygning. Vand anvendes også ved mjødbrygning, men ikke direkte i vinfremstilling. Vand er ikke bare H2O, vand er også en lang række mineraler og andre kemiske forbindelser, der har indflydelse på vandets karakter.
I dette afsnit ser vi på, hvad vand er, hvordan det indgår i produktionen af alkoholiske drikke og hvilken betydning det har.
Vandets livscyklus
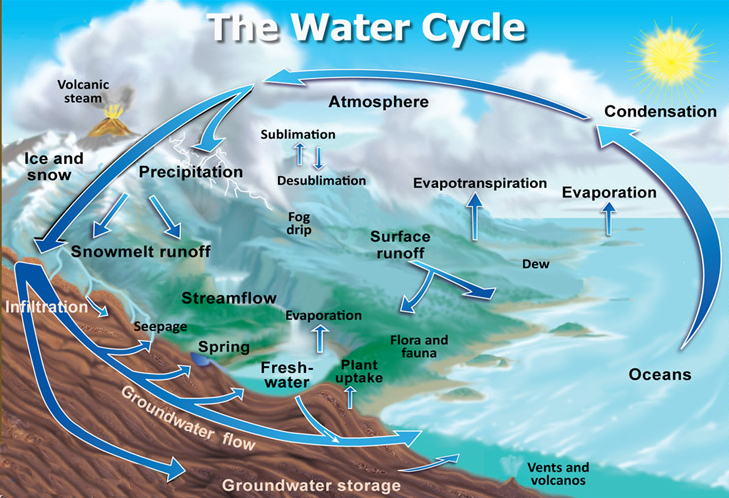
Vandets kredsløb forekommer når vand fra søer, hav, jord overflader samt fordampning fra planter bliver til vanddamp i skyer. Hvorefter vanddampe i atmosfæren samles, kondenserer, danner skyer og bliver til regn, der lander på jorden. Men allerede inden vandet har ramt jorden, er det blevet til mere end bare ren H2O. Regnvandet optager forskellige gasser fra luften, herunder svovldioxid (SO2), kvælstofoxider (NOx) og kuldioxid (CO2), som reagerer med vand på vejen ned fra skyerne inden regnvandet rammer jorden.
Når vandet rammer jorden, bliver det til overfladevand, ligger på jorden, i søer og løber i vandløb samt optager flere ingredienser fra det miljø, der omgiver vandet, noget af vandet optages af planterne og noget vand fordamper, men en del vand trænger ned i jorden.
Overfladevandet siver gennem jorden og passerer forskellige jordlag, hvor vandet udsættes for varme/kulde og tryk, vandet afgiver organiske stoffer, optager forskellige mineraler og danner kemiske forbindelser, i et omfang afhængig af de enkelte jordlags beskaffenhed. Vandet forvitrer med calcium, magnesium, mineraler samt andre kemiske stoffer og danner karbonat-forbindelser. Herefter kalder vi vandet grundvand og det ligger i grundvandsreservoirer i op til mange år. Mængden af calcium og magnesium bestemmer vandets hårdhed.
Vi tager den lige en gang til med lidt flere detaljer. Regnvand samt smeltevand optager CO2, herefter dannes kulsyre (H2CO3) i vandet, som nu er overfladevand. Kulsyre samt eventuelle andre syrer opkoncentreres efterhånden, som vand optages i planter eller fordamper. Vand (inklusive kulsyre) trænger gennem jorden, går i forbindelse/forvitrer med calcium og magnesium (samt eventuelle andre kemiske stoffer) og danner karbonat-forbindelser ( CaCO3 og CaMg(CO3)), som bestemmer vandets pH-værdi.
Eller kort fortalt, kulsyre i vand forvitrer med calcium og magnesium, som danner karbonatforbindelser (CO3). Samtidig dannes en buffereffekt, som modstår ændringer i pH. I vand kalder vi bufferen for alkalinitet, det er vands kvantitative evne til at neutralisere syre. Hvis H+ øges så optages H+ af karbonatforbindelser fx CaCO3 ; hvis H+ reduceres afgives H+ fra kulsyre (H2CO3 ).
Figur : John Evans and Howard Periman, USGS, Public domain, Wikimedia Commons
Alkalinitet i vand er bestemt af indholdet af karbonat, som er dannet, når grundvand (inklusive kulsyre) reagerer med kalk, dolomit, kridt og andre mineraler. Denne reaktion mellem kulsyre i vand og kalkholdige mineraler danner karbonatforbindelser – eksempelvis calciumkarbonat (CaCO3 / kalk) og calciummagnesiumcarbonat (CaMg(CO3) / dolomit), som nævnt ovenfor.
Buffer er en substans evne til i en opløsning at modstå ændringer i pH. Hvis eksempelvis H+ øges så optages H+ af karbonatforbindelser, hvis H+ reduceres afgives H+ fra kulsyren (H2CO3),
Vands hårdhed beregnes ud fra ion-mængden i calcium og magnesium.
Tabel : vands hårdhed målt i CaCO3 ppm, mgr/liter og ° dH (grad deutscher Härte)
| Ppm CaCO3 | mgr/liter | ° dH | |
| Meget blødt | 0 … 35 ppm CaCO3 | 0 … 15 | 0 … 2,1 |
| Blødt | 35 … 75 ppm CaCO3 | 15 … 35 | 2,1 … 4,9 |
| Middel hårdt | 75 … 150 ppm CaCO3 | 35 … 70 | 4,9 … 9,8 |
| Hårdt | 150 … 300 ppm CaCO3 | 70 … 150 | 9,8 … 21 |
| Meget hårdt | > 300 ppm CaCO3 | > 150 | > 21 |
For bryggerne er vand en vigtig ressource med forskellige egenskaber. Der kan være stor forskel på vand. Grundvandet har forskellig sammensætning, afhængig af de jordlag vandet passerer. En af egenskaberne ved grundvand er dets syre-base-balance, som ligger i området 6 til 8 i pH-værdi. Det har betydning for enzym-aktivitet under mæskning, at der er nogenlunde styr på, hvor sur eller hvor basisk brygvandet er.
Hvis pH er over 7, kalder vi substansen for basisk og er pH under 7, kalder vi substansen for syre. Syre-base-balancen kan ændres, enten ved at tilføre syre for at sænke pH eller ved at tilføre en base for at hæve pH. Det lyder jo temmelig enkelt, men det er det bare ikke! For buffereffekten har indflydelse på omfanget af, hvor meget den tilsatte syre henholdsvis tilsatte base har effekt på syre-base-balancen.
Grundvandet optager CO2, reagerer med calciumkarbonat (CaCO3) samt magnesiumkarbonat (Mg(CO3)2) og danner karbonat- og bikarbonat-forbindelser, hvilket har indflydelse på vandets pH-værdi. Det er sammensætningen af disse forbindelser, der bestemmer vandets pH-værdi, hvilket præciseres yderligere nedenfor.
Langt de fleste hjemmebryggere bruger vandværksvand til deres øl, dvs. grundvand pumpet op fra undergrunden fra det lokale vandværk. Her i Danmark har vi kvalitetskontrol og myndighedskrav, det sikrer vand af høj kvalitet, som ikke er forurenet af mikrobiologiske partikler etc. De fleste hjemmebryggere bruger da også vandet fra hanen uden at bekymre sig mere om det. Men er vandet nu også godt nok eller måske kan det blive en lille smule bedre, det er overvejelser en del hjemmebryggere gør, når de har brygget et stykke tid.
Vi bruger vand til mange forskellige ting i bryggeriet, først og fremmest til at mæske. Men også til rengøring, køling og eftergydning (sparging) bruger vi vand. Typisk bruger vi 5 til 10 liter vand til hver liter øl. Vandet er en vigtig ressource, så det giver god mening, at have fokus på vandets sammensætning og dets kvalitet.
På landet tilfører landmanden kalk (calciumkarbonat: CaCO3) til sin jord for at gøre jorden mindre sur. Jorden binder den CO2, der er i luften, det sænker pH og gør jorden sur, ved at tilsætte kalk (CaCO3) hæves pH. Det er lidt den samme problematik, vi har med vand.
De sidste detaljer om vand
Vandets mindste byggesten er atomerne i et vandmolekyle. To hydrogen-atomer og et ilt-atom udgør byggestenene i et vandmolekyle, dvs. dihydrogenmonoxid. Strukturen mellem atomerne og dets poler giver vandmolekylets dets ladning og dermed dets polære karakter. Dipol kaldes molekyler med denne forskel i ladning. Vandmolekylets polaritet gør det i stand til med lethed at tiltrække andre ioniserede og polære molekyler. Derfor er vand et godt opløsningsmiddel, til opløsning af eksempelvis syrer, alkoholer og salte.
Vandet fra dit lokale vandværk har en pH-værdi, der ligger i området 6 til 8, hvilket har betydning for enzym-processen under mæskning. Efter tilsætning af malt i vand af almindelig gennemsnitskvalitet, så vil vandet ved almindelig mæsketemperatur (ca. 65 grader) have en pH-værdi i området 5,0 til 5,5, det er den anbefalede pH-værdi. Maltprofilen har indflydelse på pH-værdien.
Høj pH-værdi i vandet skaber gode betingelser for mørkt øl, da mørkt malt typisk har en lavere pH-værdi end lys malt og dermed kompenserer for den forholdsvise høje pH-værdi. Omvendt med lav pH-værdi i vandet, det egner sig godt til de lyse øl, da det lyse malt typisk har en højere pH-værdi end det mørke malt og dermed kompenserer for vandets forholdsvise lave pH-værdi.
Det er forskellige grundstoffer og kemiske forbindelser i vandet, som regulerer pH-værdien. De forskellige kemiske stoffer påvirker vandet i forskelligt omfang, der samtidig har betydning for vandets buffersystem. Buffer er en syre eller en base og dens korresponderende base eller syre, som modstår pH-ændringer, dvs. en buffer virker som base, hvis der tilsættes syre, og omvendt, en buffer virker som syre, hvis der tilsættes base.
Eksempler på korresponderende Syre/base-par
| H2CO3 – kulsyre | ←→ | H+ + HCO3– : hydron + bikarbonat |
| HCO3– – bikarbonat | ←→ | H+ + CO3– : hydron + karbonat |
| H2O – vand | ←→ | OH– : hydroxid |
| H3O – hydronium | ←→ | H2O : vand |
Syre – base
Bufferegenskab i vand bestemmer, i hvilket omfang vi kan tilpasse pH-værdien for brygvandet. I vandværksvandet er det karbonat og bikarbonat, der bestemmer vandets alkalinitet, under mæskning vil fosfat fra malt også bidrage til brygvandets alkalinitet. Alkalinitet er en opløsnings evne til at neutralisere syre.
Basis malt har en pH-værdi på 5,2 til 5,6 og er alkalisk. Special malt har typisk en pH-værdi på under 5,2 og er ikke alkalisk. Syre, calcium og magnesium sænker pH-værdi. Modsat karbonat, som hæver pH-værdien i malten.
Under mæskning reduceres pH yderligere på grund af maltens indhold af fosfat og eventuel melanoid. Det er vigtigt, at mæskevandets pH er i området 5,0 til 5,5. For lav pH (<5,0) forringer humleudnyttelse og forringer øllets krop. For høj pH (>5,5) resulterer i en øl med en mere kedelig malt karakter.
Brygvand og maltsammensætning har indflydelse på mæske-pH. Har du problemer med din vandkvalitet, så lav en test på et lille repræsentativt udsnit af dit malt og vand, mål pH og estimer herefter, hvor meget du skal tilsætte af syre/base for at justere mæskens pH til det ønskede mål.
Vandanalyse fra dit vandværk
Vil du vide mere om dit vand, så har det lokale vandværk udgivet en vandanalyse af dit vand og gjort den tilgængelig på deres hjemmeside. Den er et godt dokument til at få større indblik i vandkvaliteten fra dit lokale vandværk.
I det følgende vil jeg med udgangspunkt i vandanalysen fra vandværket i Odense gennemgå nogle af de vigtigste begreber, analysen måler på forskellige stoffer og tilstande, der har betydning for anvendelse af vand i bryggeriet.
Vandanalysen starter med identifikationsoplysninger for prøven, der ligger til grund for analysen, dvs. et entydigt unikt nummer, adresse, dato, navn på prøve-tager, prøvens omfang, etc.
Herefter opgives eventuelt oplysninger om :
– pH-værdi (ion-balance).
– temperatur, målt i celsius.
– ledningsevne, også kaldet konduktivitet, det er vandets evne til at lede elektricitet. Ledningsevne er proportional med indholdet af salte i vandet (fx. klorid, nitrat og sulfat). Demineraliseret vand har ingen ledningsevne.
– turbiditet angiver vandets klarhed.
– farvetal, gulfarvning resulterer i et højt farvetal og skyldes højt indhold af organisk materiale / humus i vandet.
– farve (subjektiv vurdering).
– klarhed (subjektiv vurdering).
– lugt (subjektiv vurdering).
– smag (subjektiv vurdering).
Så kommer en opremsning af mængden af forskellige kemiske stoffer, der forekommer i prøven:
– chlorid (Cl) fremhæver maltkarakter anbefalet mængde < 100 ppm.
– bicarbonat (HCO3– ) også kaldet hydrogenkarbonat, bidrager til buffereffekt og alkalinitet.
– nitrat (NO3) kan være sundhedsskadelig, max 50 mg/ltr.
– nitrit (NO2) tegn på bakteriel forurening, max 0,01 mg/ltr.
– total-alkalinitet
– sulfat (SO4) fremhæver humlekarakter og tørhed, max 250 mg/ltr.
– phosphor (P) max 0.15 mg/ltr. i vand, forekommer i malt og har betydning for buffereffekt, alkalinitet og mæske-pH.
– calcium (Ca) har betydning for vandets hårdhed samt for gæring, klaring og mæskning. Anbefalet mængde : 50 – 150 ppm
– magnesium (Mg) har betydning for vandets hårdhed samt for gæring, klaring og mæskning. Har betydning for enzymet decarboxylase. Anbefalet mængde : 5 – 40 ppm
– natrium (Na) har betydning for smag og duft. Anbefalet mængde 0 – 50 ppm
– kalium (K) anbefalet mængde < 10 ppm
Samt forskellige andre data om vandet som har mindre betydning for hjemmebryggeren.
Bemærk at vandanalysen også omfatter en subjektiv vurdering af vandkvalitet. Farve, klarhed, lugt og smag er en del af analysen. Det er god rutine at hjemmebryggeren også løbende vurderer brygvandets farve, klarhed, lugt og smag.
Vedr. pH-værdi så daler pH-værdien når regnvand går i forbindelse med CO2 og andre syre-forbindelser i luften (se ovenfor). Når vandet rammer jorden og trænger ned gennem undergrunden reagerer det med andre stoffer, eksempelvis karbonat (CO3) og bikarbonat (HCO3), som hæver pH-værdien. Vandets pH-værdi er vigtig for at opnå optimale betingelser under mæskning.

De vigtigste stoffer i vand præsenteres nedenfor :
– Calcium (Ca+2) er det 20. grundstof i det periodiske system, det er et jordalkalimetal med kun to elektroner i yderste skal. Calcium sænker pH. Det er et reaktionsvilligt metal, der reagerer med både ilt, kvælstof, vand og fosfater i malt. Calcium findes ikke i fri form i naturen, men forekommer i kemiske forbindelser fx. i kalksten (calciumkarbonat), calciumkarbonat hæver pH. Calcium er vigtigt for alle, det bidrager til mange forskellige opgaver i levende organismer. I ølbrygning bidrager calcium til bedre flokkulering og dermed en mere ren øl samtidig fremhæves smag og duft. Calcium bidrager også til at sænke pH under mæskning. For meget kan dog hæmme fermentering, anbefalet mængde er mellem 50 og 200 ppm for at opnå god fermentering. Calcium skaber bedre vilkår for enzymaktivitet og klaring. Vandets hårdhed afhænger af mængden af magnesium og calcium. Calciumkarbonat (CaCO3) hæver pH. Forhandles under betegnelsen: Calciumsulfat (CaSO4).
– Kalium (Potassium, Ka) er det 19. grundstof i det periodiske system, det er et alkalimetal med kun en elektron i yderste skal og hæver pH-værdi. Ligesom calcium har det stor reaktionskraft, kalium forekommer i kemiske forbindelser fx. som kaliumkarbonat (potaske, KaCO3). Niveauet af kalium i almindelig vand er sjældent højt. Men vær opmærksom på, at uklart vand eller vand der er tilsandet eller bundfælder fint leragtig grus og smager saltet, kan have en for høj koncentration af kalium, dvs. mere end 500 ppm.. Urten kan have et relativt højt niveau af kalium på 300 – 500 ppm, som kommer fra malten.
– Magnesium (Mg+2) er et metal og er betydningsfuld for nukleinsyrernes kemi. Magnesium er vigtig næring til enzymet pyruvatdecarboxylase, som er aktiv i det næstsidste led i dannelse af ethanol. Der er magnesium i malt, test har vist, at en urt lavet på destilleret vand indeholder 70 ppm magnesium ved 1040 grader Oe (”Water” side 46). Hvis der er tilsat megen sukker og andre tilsætningsstoffer i urten, så kan det være nødvendigt at tilsætte extra magnesium. Foruden bidrag til enzymers katalytiske funktion, så bidrager magnesium til proteinkoagulering. Magnesium sænker pH i en substans. Vandets hårdhed afhænger af mængden af magnesium og calcium. Magnesiumkarbonat (MgCO3) hæver pH. Forhandles under betegnelsen: Epsom Salt eller magnesiumsulfat (MgSO4).
– Sulfat (SO4-2) er en svovlforbindelse og et salt af svovlsyre, anbefalet mængde 100 … 350 ppm., fremhæver humlekarakter. Må ikke forveksles med sulfit også kaldet SO2 eller svovldioxid.
– Klorid (Cl) klor er et grundstof, som er gasformig under normalbetingelser. Det giver en forfærdelig bismag, selv i små mængder. Vandværker i Danmark bruger heldigvis ikke klor.
– Natrium (Sodium, Na) mens natriumioner spiller en afgørende rolle i dyr, så kan planter helt undvære natriumioner. “Ren” vegetar-kost er derfor fattig på salt. Natrium findes ikke frit i naturen pga. dets høje reaktionsvillighed. Natrium binder sig nemt til klor, NaCl er salt. Natriumbicarbonat (NaHCO3) hæver pH-værdi. Anbefalet mængde er max. 100 ppm.
– Karbonat (CO32-) er syrerest af kulsyre, kulsyresalt og korresponderende base til bikarbonat. Karbonat indgår i fx kalk (calciumkarbonat (CaCO3)) og hæver pH-værdi. Er set forhandlet under betegnelsen: Deacidifier FBN (Calcium Carbonat).
– Hydrogenkarbonat (HCO3–) også kaldet bikarbonat er korresponderende base til kulsyre. Forhandles under betegnelsen : Natriumbikarbonat (NaHCO3) også kaldet bagepulver. Hydrogenkarbonat hæver pH.
Ovennævnte stoffer bidrager til at hæve eller sænke pH. Almindelig god kvalitets malt vil i almindelig god kvalitets vand fra det lokale vandværk generere god mæskevand med en pH på ca. 5,1 til 5,4 ved ca. 65 graders celsius. Er der behov for at justere lidt op eller lidt ned, så vil mørk malt typisk sænke pH-niveauet og lys malt vil typisk hæve pH-værdien under mæskning.

