2. Grundviden

Kulstof atom består af 2 elektroner i skal K og 4 elektroner i skal L. Kulstof indgår i alle former for liv.
Der var engang …
For næsten 14 milliarder år siden blev universet dannet ved en enorm eksplosion, Big Bang kalder vi den hændelse. Ingen atomer endsige protoner, neutroner eller elektroner kan eksistere i det extreme varme og tryk, der blev dannet under de betingelser. I starten bestod rummet af en quark- og glucon-plasma. Men et par minutter efter Big Bang har rummet udvidet sig, hvilket medfører, at temperatur og tryk aftager så meget, at protoner samt neutroner dannes, de begynder at binde sig sammen for at danne atomkerner.
Men der går yderligere 370.000 år førend universet har udvidet sig og er nedkølet så meget, at elektroner binder sig til atomkernerne og danner de første simple atomer. I starten består universets masse af næsten 75% hydrogen og næsten 25% helium. Derudover var der meget små mængder af yderligere enkelte simple atomer. Langt de fleste andre grundstoffer dannes efterfølgende i de stjerner, der dannes i universet og super-novaer sørger for, at de nye atomer spredes i universet.
Atomer og molekyler er byggestenene i den fysiske verden vi lever i. Det er også byggestenene i de processer, vi igangsætter når vi fermenterer og fremstiller en alkoholisk drik. Vi skal have en fælles elementær grundviden om fysik og kemi, for at kunne forstå, hvad der exempelvis sker i gærcellen under fermentering, hvordan sukker dannes og er opbygget, hvad vi måler, når noget er surt eller basisk.
Formålet med dette afsnit er at skabe klarhed over de væsentligste fysiske og kemiske grundbegreber, der har betydning for hjemmebryggeren. Først gennemgår vi grundlæggende basisviden om kemi, det danner grundlag for at begribe nogle af de vigtigste grundstoffer, som indgår i dannelsen af alkohol og andre stoffer. pHværdi, ion-balance, syremængde og syre/base er begreber, der gennemgås til sidst i dette afsnit.
Kemiske byggesten / grundviden
Atomer er de mindste byggesten og de består af en kerne, hvor der er en eller flere positivladede protoner og nul eller flere neutroner. Negativ ladede elektroner kredser i baner udenom kernen. Antallet af protoner bestemmer, hvilket grundstof atomet tilhører. Hydrogen (som også kaldes brint) har en proton i kernen, helium har to protoner, lithium har tre protoner etc. I kernen er der også nul eller flere neutroner. Summen af protoner og neutroner kalder vi nukleoner.
Antallet af neutroner bestemmer hvilken variant af grundstoffet atomet tilhører, også kaldet isotop. Exempelvis har grundstoffet kulstof to stabile isotoper, carbon-12 (12C) har seks protoner og seks neutroner, hvilket giver tolv nukleoner i kernen. Og carbon-13 (13C) har seks protoner og syv neutroner, hvilket giver tretten nukleoner i kernen.
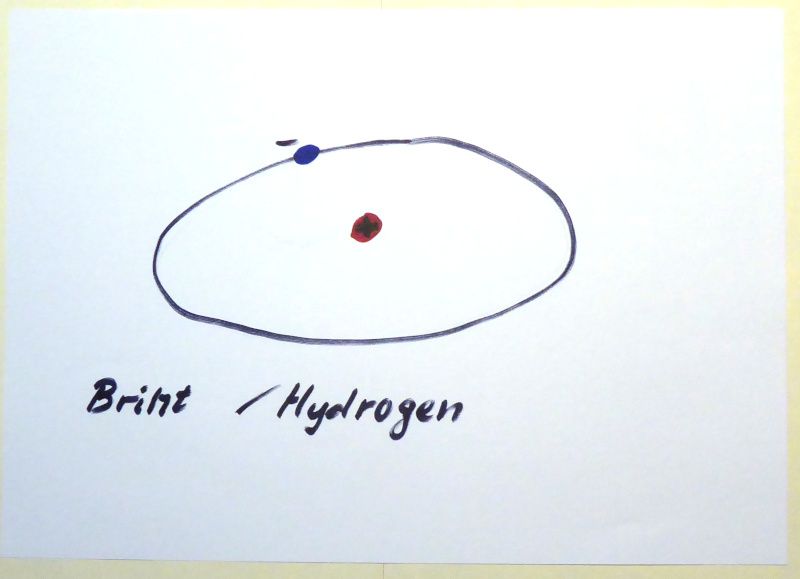
Hydrogen er det mest simple atom og samtidig det mest udbredte atom i universet.
Udenom kernen cirkulerer elektronerne rundt i såkaldte skaller. Der er op til fem skaller, i hvilke elektronerne befinder sig i. I den første skal (K) er der op til 2 elektroner, i den næste skal (L) er der op til 8 elektroner, i den tredje skal (M) er der op til 18 elektroner, i den fjerde skal (N) er der op til 32 elektroner, i den femte skal (O) er der op til 50 elektroner.
Skaller er en model til beskrivelse af elektroners struktur i et atom.
| Elektronskaller : 2(n2), hvor n = skalnummer Skal Skalnr. Maks. antal elektroner K 1 2 L 2 8 M 3 18 N 4 32 O 5 50 |
Atomer og molekyler fremtræder i følgende sammenhænge:
Ion – alle atomer har som udgangspunkt lige mange protoner og elektroner, dog er et ion et atom, der har afgivet eller optaget en eller flere elektroner end antallet af protoner i det pågældende atom.
Isotop – kernen i et atom (nukleon) består af en eller flere protoner og nul eller flere neutroner. Antallet af protoner bestemmer grundstoffet, men det er muligt at det samme grundstof indeholder forskelligt antal neutroner. Disse varianter af det samme grundstof kaldes for isotoper.
Isomer – en af to eller flere kemiske forbindelser, der har samme molekyleformel (grundstofindhold), men forskellig opbygning. Isomerer har således forskellige strukturformler, fx glukose og fruktose, der har samme molekyleformel: C6H12O6, men forskellig struktur.
Valenselektroner – er typisk elektroner i den yderste skal af et atom, molekyle eller fast stof. Valenselektroner deltager i kemiske bindinger.
Bindinger
Kemiske bindinger, kaldes det, når atomer bindes sammen til molekyler. Der findes følgende fem typer bindinger :
1) Ionbinding, det er en elektrisk tiltrækning mellem to modsat ladede ioner. Ionbindinger er relativt stærke bindinger. Exempel: Natriumchlorid (Na-Cl+) også kaldet køkkensalt.
2) Elektronparbinding, kaldes også kovalent binding. Der skelnes mellem upolær elektronparbinding (fx. mellem ens atomer N2 eller H2) med elektronegativitet 0 eller tæt på 0. Og ved polær elektronparbinding med svag elektronegativitet, der ligger i området 0,5 til 1,7 Exempel: H2O
3) Hydrogenbinding er en binding mellem det svage brintatom og et af de elektronegative atomer som ex. ilt, kvælstof eller flour.
4) Metalbinding er et forhold, hvor elektroner holder sammen på positivt ladede atomer.
5) Kompleksbinding forekommer, når et (positivt) metal-ion binder en eller flere negative ioner eller polære molekyler til sig.
Helium og hydrogen er eksempler på to atomer og deres bindinger eller mangel på samme.
Helium binder sig stort set ikke til andre atomer, det er et stabilt atom, med to protoner og to elektroner, der danner et elektronpar. Det stabile atom helium er kendetegnet ved at være en gas, kun under ekstreme forhold (tryk og kulde) forekommer helium flydende eller som et fast stof. Heliums ikke-metaliske og inaktive kemiske egenskaber gør, at det tilhører gruppen af ædelgasser. Helium har meget svært ved at binde sig til andre grundstoffer.
Hydrogen består af en proton og en elektron, det er ikke et elektronpar og brint-atomet er ustabilt. Hydrogen har let ved at optage/afgive en elektron og kan dermed forekomme enten som en negativladet ion (H–) med to elektroner, der danner et elektronpar eller som en positivladet ion (H+) uden elektroner. To brint-atomer kan også slå sig sammen (H2), de binder sig sammen og ”deler” de to elektroner de har for at danne et elektronpar, det kaldes kovalent binding.
Mine yndlings atomer 😉
Nu ved vi noget om atomernes opbygning og deres egenskaber. Der findes 118 forskellige atomer/grundstoffer ifølge det periodiske system. Atomerne kan binde sig sammen med andre atomer og danne molekyler, som indgår i de mindste fysiske partikler. Enkelte af de 118 grundstoffer har særlig betydning for bryggeren. Det vil jeg komme ind på i det følgende:
Hydrogen / brint var det mest udbredte atom, da universet blev dannet. Hydrogen udgjorde næsten 75% af universets masse, samlede sig i store skyer og dannede de første stjerner. I stjernerne startede en fusionsproces, som efterfølgende udvikler de tungere grundstoffer. I de største stjerner går processen stærkt og ender med en supernova – en kæmpe stjerneeksplosion, som spreder de nydannede grundstoffer ud i universet. Hydrogen (og helium) er oprindelig et ur-atom og dermed alle grundstoffers moder. Men hydrogen er også det mindste af alle atomer og med sin ensomme elektron er den ustabil. I mange sammenhænge oplever vi hydrogenatomet optræde alene uden elektron, så kalder vi det for et hydron (H+).
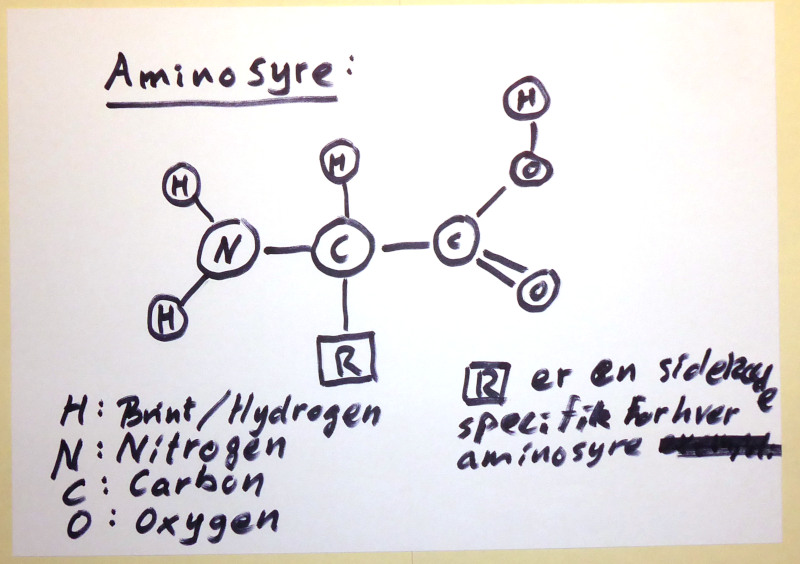
Billedtext : Aminosyre, generel struktur for en alpha-aminosyre.
Carbon / kulstof er det fjerde mest forekommende grundstof i universet efter hydrogen, helium og oxygen. Carbon indgår i alle kendte livsformer. Dets evne til at binde sig til andre kulstof-atomer og andre atomer i øvrigt gør det til et unikt grundstof, der kan danne millioner af forskellige kemiske forbindelser.
Det kan lave meget lange kæder af stof, hvor kulstof-atomerne binder sig til hinanden og holder sammen på molekylerne. Peptidkæder i et protein er et eksempel på lange kæder af aminosyrer. Aminosyre består af aminogruppe (H2N), en sidekæde (også kaldet R-gruppe, den definerer aminosyren), en carboxylgruppe (-COOH), et hydrogen-atom og et carbon-atom, der holder sammen på det hele.
Carbon kan desuden optræde i vidt forskellige kemiske tilstande, fx. grafit, diamant, kulhydrater, proteiner, kalk (CaCO3) og meget mere. Dets evne til at holde sammen på atomer og molekyler er en særlig egenskab, der kendetegner kulstof-atomet, som gør dette atom til et af mine fire favoritatomer.
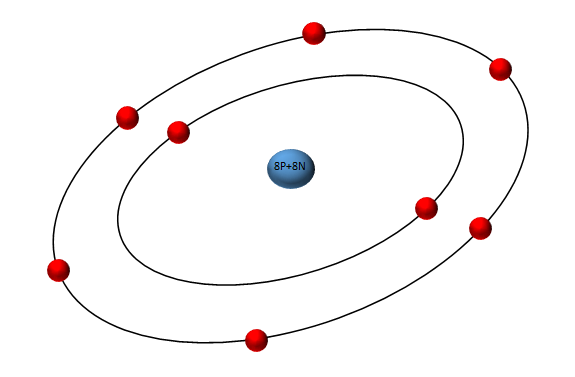
Billedtext : iltatom
Oxygen / ilt er et næsten uhyggeligt fascinerende grundstof. Ilt er forudsætning for liv, men samtidig er ilt også næring til noget så destruktivt som ild. Et ilt-atom og to hydrogen-atomer er et vand-molekyle, som vi ikke kan leve uden. Men samtidig er ilt næring til korrosion og oxidering, som vi helst vil undgå. Ilt indgår i kulhydratforbindelser og proteinforbindelser. På den ene side er grundstoffet ilt lidt af en ballademager, men samtidig kan vi simpelthen ikke undvære dette atom.
Ilt dannes ved planternes fotosyntese og udgør næsten 21% af luften i atmosfæren. Ilt er et stærkt oxidationsmiddel, der nemt bindes med de fleste andre grundstoffer, da det kun har seks elektroner i yderste skal. Ilt vil derfor gerne gå i kemisk forbindelse med andre stoffer for at kompensere for de manglende elektroner. Det gør ilt til et effektivt desinfektionsmiddel, som det exempelvis forekommer ifa. brintoverilte (H2O2 hydrogenperoxid). Desuden indgår ilt i mange sammenhænge af betydning for liv, fx. aminosyrer og kulhydrater indeholder også ilt.

Billedtext : Nitrogen atom.
N itrogen / kvælstof udgør godt 78% af jordens atmosfære. Nitrogen indgår i ammoniak, salpetersyre, organiske nitrater, cyanider(CN-), aminosyre (og dermed også i proteiner), nukleinsyrer, neurotransmittere, animalsk affald, eksplosive forbindelser og i alkaloider. Nitrogen indgår i mange forbindelser, der har betydning for liv her på jorden.
Nitrogen er et vigtigt element i proteiner og andre organiske forbindelser. I aminosyre indgår nitrogen sammen med to hydrogen-atomer i aminogruppen, der er bundet til kulstofatomet. Nitrogen indgår også i nogle af molekyle-forbindelserne i R-gruppen, som også er bundet til kulstofatomet.
Bakterier og nedbrydende organismer i jorden optager nitrogen og hydrogen, som omdannes til ammoniak (NH3), hydrogen frigives og nitrogen omdannes til nitrit (NO2–) og efterfølgende til nitrat (NO3–), det er den korte version af kvælstofkredsløbet.
Nitrit er et salt og kan anvendes som tilsætningsstof til kød for at opnå bl.a. farvedannelse og konservering. Afhængigt af forholdene kan nitrit, der er den korresponderende base til den svage syre salpetersyre, oxideres til nitrat eller reduceres til radikalet nitrogenoxid.
Saltpetersyre dannes ud fra nitrogendioxid (NO2) og vand. Salpetersyre dannes naturligt fra nitrater udledt af menneskelige aktiviteter. Salpetersyre er en af de forbindelser, der findes i syreregn og bidrager til forsuring af jordbund og vandmiljø.
Nitrogen er også et vigtigt element i uorganiske forbindelser. Ligesom ilt lever nitrogen et spektakulært liv! I nogle sammenhænge kan vi ikke undvære nitrogen og i andre sammenhænge vil vi gerne være det foruden. Nitrogen i brygverdenen finder vi i proteiner og i næring til fermenteringsprocessen.
pH / ionbalance
pH er et mål for mængden eller koncentrationen af H+/hydrogenioner/hydroner/brintioner – kært barn har mange navne. Vi siger, at pH angiver syre/base-balancen.
Inden indførelse af pH-skalaen for mere end 100 år siden, bestemte man surhedsgraden i en væske subjektivt. Det er ikke godt nok, mente S. P. L. Sørensen, der var leder af Carlsbergs laboratoriums kemiske afdeling. Indenfor brygning er det vigtigt at have styr på surhedskoncentrationen. Sørensen lavede en række forsøg og indførte pH-skalalen som minus-logaritmen til H+ koncentrationen, pH = -log10 [H+] .
Med andre ord pH er en forkortelse for potentia hydrogenii og er en måleenhed til bestemmelse af syre/base-balancen i en opløsning. pH-værdier i området 0 til 7 er en syre og i området 7 til 14 er en base. pH kan måles med indikatorpapir eller pH-meter. Måling af H+ forekommer typisk i en vandig opløsning, derfor forekommer det ofte, at der anvendes notationen: H3O+ ( = H+ + H2O ).
pH er en måleenhed for syrestyrke dvs. koncentrationen af aktive brintioner (H+), som nævnt ovenfor:
Hvis pH = 9, så er koncentrationen af aktive brintioner = 1 x 10-9
Hvis pH = 7, så er koncentrationen af aktive brintioner = 1 x 10-7
Hvis pH = 2, så er koncentrationen af aktive brintioner = 1 x 10-2
Ioner er ladede partikler. Når et atom har mistet/optaget en (eller flere) elektroner, siges det at være ioniseret. pH er måleenheden for syrestyrken dvs. ion-balancen, pH fortæller os om forholdet mellem syre og base.
K ation En syre er et stof med en høj koncentration af aktive brintioner (H+). Når neutrale stoffer afgiver elektroner dannes positivt ladede ioner også kaldet kationer, ex: hydron (H+).
Anion En base er et stof med en lav koncentration af aktive brintioner (H+). En base er et stof, der kan optage hydroner (H+). Når neutrale stoffer optager elektroner dannes negativt ladede ioner også kaldet anioner, ex: hydridion (OH–).
I ølbrygning er det pH-værdien under mæskning, som er vigtig. Det er først, når vi varmer vand og malt op, at vi starter selve mæskningen, aktiverer enzymprocessen og udtrækker det gode forgærbare sukker. Det betyder, at det er under mæskning, vi skal have den korrekte pH-værdi. Vi siger, at mæske-pH er vigtigere end vand-pH, fordi godt øl og optimal enzym-aktivitet afhænger af pH-værdien samt temperatur under mæskning.
Den anbefalede optimale mæske-pH varierer en del, afhængig af hvem man spørger. De fleste anbefaler dog, at der mæskes i området 5,1 til 5,5 ved 65 grader celsius, hvis prøve måles ved stuetemperatur så skal pH være 5,4 til 5,8 (se ”How to brew” si. 158). Hvis pH er under 5 hæmmes beta-amylase og humleudnyttelse forbliver forholdsvis lav, smagsmæssigt medfører det tam smag og manglende karakter i det færdige øl. Hvis pH er over 5,5, hæmmer det også beta-amylase samt resulterer i forkert humleudnyttelse dvs. grov humlekarakter og bare en forkert smag.
O gså ved fremstilling af vin, cider og mjød er det lidt forskelligt hvilken pH-værdi der anbefales under gæring. Men de fleste anbefaler at der gæres i området 3,0 til 4,0, cider gæres i den lave ende og mjød i den høje ende af dette interval. pH-strips og pH-meter er de mest udbredte metoder til måling af ion-balancen og dermed syre/base-forholdet i en væske.

pH-strips
pH-strips (eller indikatorpapir) er en papirstrimmel, der indeholder lakmus. Lakmus er et farvestof, der udvindes fra forskellige lavarter og som bliver blåt i en basisk opløsning og rødt i en sur opløsning, afhængig af den pH-værdi papiret udsættes for. Det er en visuel bedømmelse af papirets farve, der danner udgangspunkt for at bestemme substansens pH-værdi.
pH-meter
Et pH-meter måler pH mere præcist v.hj.a. en elektrode. Nogle pH-metre kan angive pH med op til flere decimalers nøjagtighed.
Bicarbonat hæver pH mens calcium og magnesium sænker pH, det er den korte og ufuldstændige version af hvilke tilsætninger, der kan anvendes til regulering af brygvand. Næste afsnit har en lidt mere detaljeret liste over forskellige tilsætninger, der kan anvendes til at regulere syremængde og syrebalance.
Syremængde (TA)
Passende koncentration af substansen, dvs. passende temperatur, vandopløsning og passende syre-base balance, det er de vigtigste forudsætninger for en sund fermentering. Uanset om du fremstiller vin, brygger øl eller laver andre former for alkoholiske drikke, så er den rigtige pH-værdi en forudsætning for at fermenteringen lykkes. Ovenfor er beskrevet, hvordan pH-værdien dvs. syre-base-balancen, er et redskab til, at vi får skabt de mest optimale betingelser for enzymprocessen (mæskning) under ølbrygning.
Når vi fremstiller vin er situationen en anden. Vi har allerede den gode forgærbare sukker i druer, æbler og andre former for frugt. Vi skal ikke aktivere en enzym-proces for at udtrække det gode sukker. Frugten skal ”bare” presses, mosten hældes på en beholder og tilsættes en gær. Alligevel sker det, at det færdige resultat enten bliver en sur og alt for astringent vin eller den bliver alt for tam og nærmest vammel. Syremængden er enten for høj eller for lav. Det betyder, at vi indenfor fremstilling af vin, cider, mjød etc. er særlig interesseret i syremængden.
Syremængden angives i total mængde syre, dvs. TA (Total Acid). TA omfatter alle typer syrer som forekommer i substansen, i vores verden er det typisk vinsyre, æblesyre, mælkesyre og citronsyre. TA måles i gram pr. liter ved hjælp af titrering. Forskellen på TA og pH er at pH måler ionbalancen (syrestyrke), dvs. hvor mange H+ (hydroner) der er i substansen, mens titreringsmetoden bestemmer syremængden målt i gram syre pr. liter. Syremængde i vinen måles inden der tilsættes gær.
Titrering
Titrering er en kemisk metode til at bestemme mængden af syre i en opløsning. Substansen tilføres indikator-væske og når den skifter farve, aflæses syremængden. Indikatoren er en kemisk forbindelse, som skifter farve, når syremængde overstiger et bestemt interval. Intervallet kaldes omslagsintervallet. Der findes dyre avancerede anlæg til bestemmelse af syremængde, men heldigvis findes der også low-cost løsninger, hvor vi almindelige hjemmebryggere kan følge med.
Billedtext : Acidometer fra Vinometer er et billigt kit (set til kr. 195,-) til måling af syremængde med titreringsmetoden. Andre gode firmaer laver lignende kits.
Syresammensætning er bestemt af frugtvarietet og klima. Fx. umodne druer medfører højt indhold af æblesyre og lavt indhold af vinsyre. Modne druer medfører lavt indhold af æblesyre og højt indhold af vinsyre. 90% af syren i en drue er æblesyre og vinsyre, derudover indeholder druen citronsyre og andre typer syre. Først dannes den skarpe æblesyre og når druen modnes dannes den mere milde vinsyre og noget af æblesyren omdannes til sukker.
Inden tilsætning af gær bør syreindholdet (TA) være :
- Hvidvin 7 – 12 gram/ltr.
- Rødvin 8 – 12 gram/ltr.
- Hedvin 6 – 12 gram/ltr.
Da gæring optager syre, vil vinen indeholde ca. 2 gram/ltr. mindre syre efter, vinen er færdiggæret.
Hvis syreindholdet er for højt udføres syrereduktion ved at udføre:
- kuldebehandling.
- tilføre kridt i starten af vinifikationen (fx. Desacid, calciumcarbonat).
- kaliumbicarbonat, kaliumhydrogencarbonat efter vinifikation.
- dobbeltsalt (fx. Acidex/calciumcarbonat), kaliumcarbonat eller malolaktisk gæring (som er en bakterie, der ikke reducerer, men omsætter den skarpe æblesyre til den milde mælkesyre).
- blending, dvs. bland vinen med en vin med lavt syreindhold.
Hvis der er for lidt syre, kan vinsyre (og kun vinsyre) tilsættes før vinificering. Efter vinificering kan andre syrer tilsættes for at hæve syremængde:
- calciumsulfat
- calciumchlorid
- citronsyre, nemt og billig at anskaffe
- æblesyre, skarp i smagen
- mælkesyre, blød i smagen
- vinsyre, den mest stabile syre
- blending, dvs. bland vinen med en vin med højt syreindhold
- ølbryggerne kan bruge sur malt, mørke malttyper og eventuel syrepause ved 35 grader under mæskning
Buffer i kemi
Jeg har undladt at redegøre for buffer-spørgsmålet, men vil dog blot til sidst bemærke, at vin har stor bufferkapacitet, med andre ord: syren i vin optræder som et korresponderende syre-base-par. Syren kan både optage og afgive brintioner. Den virker dermed som buffer mod pH-ændringer, derfor kan vin med stor bufferkapacitet fastholde pH-værdi selvom syremængde ændres. Det har betydning ved fremstilling af vin, men også i cider, mjød og øl. I afsnit om vand bliver buffer-spørgsmålet yderligere forklaret.
Estere og fenoler
Estere er kemiske forbindelser der dannes ved reaktion mellem alkohol og carboxylsyre samt eventuelt vinsyre samt andre frugtsyrer under kondensreaktion. Nogle estere afgiver frugtagtig smag og duft, ex. på dufte der genereres af estere er: fersken, banan, hindbær, pære, appelsin, ananas, æble, jasmin, abrikos m.m.
Fenoler er opbygget af aromatisk kulbrinte bundet til hydroxylgrupper i en ringstruktur. Fenoler er en gruppe af kemiske stoffer, der består af en hydroxylgruppe (-OH), som er bundet til en aromatisk kulbrinte. Fenoler genererer farve, garvesyre og duft typisk fra kerner, stilk og skind. Jo mere sollys en drue får, des flere fenoler og jo længere tids kontakt med skaller giver flere fenoler – dvs. farve og garvesyre som i rødvin.
Estere og fenoler gennemgåes i detaljer i afsnittet : Frugt.

Billedtext: Brint også kaldet hydrogen er det mindste atom i det periodiske system.
